找到
73
篇与
最新研究
相关的结果
-
 阿尔茨海默病新药有效!所有消减患者淀粉样蛋白斑块的努力可能都白费了? 最新数据显示,阿尔茨海默病新药lecanemab可显著改善患者的认知障碍:接受lecanemab治疗的早期阿尔茨海默病患者一年半后,认知功能的下降速度减缓27%。 这款新药产生疗效以及最新发表的学术论文,都指明一个方向:导致阿尔茨海默病的直接原因似乎不是我们过去以为的“β-淀粉样蛋白沉积”,而是“可溶性β-淀粉样蛋白水平降低”。新论文的作者团队于《对话》(The Conversation)杂志撰文介绍自己的颠覆性理论。 1906年,精神病学家兼神经解剖学家阿洛伊斯·阿尔茨海默(Alois Alzheimer)在德国蒂宾根的精神病学家聚会上报告了“大脑皮层的一种特殊而严重的病程”。 病例是一名50岁女性,表现出记忆力减退、错觉、幻觉、攻击性和精神错乱等症状,且病情不断恶化,直到5年后去世。在尸检过程中,阿尔茨海默教授注意到她大脑内存在明显斑块,也就是今天我们所谓的“β-淀粉样蛋白的团块”——主流理论中导致阿尔茨海默病的直接原因。然而,此理论有两大疑点, 一方面,它无法解释为什么许多人(甚至包括老年群体)在没有任何神经系统症状(例如记忆丧失)的情况下,大脑中也存在斑块。另一方面,旨在减少这些斑块的药物临床试验一直没能取得成功 ,直到最近,并不以减少斑块为目标的单克隆抗体药物lecanemab传来捷报。 斑块并非导致痴呆的直接原因,低水平的淀粉样蛋白才是。 β-淀粉样蛋白简称Aβ,是淀粉样前体蛋白的水解产物,可由多种细胞产生,循环于血液、脑脊液和脑间质液,其中一种亚型——Aβ-42,被主流理论认为与阿尔茨海默病密切相关。 当此类蛋白以不溶性的斑块形式积聚时,原本正常循环的、发挥着重要功能的可溶性Aβ便相应减少 。一些研究表明,可溶性β-淀粉样蛋白42水平的下降会导致患者病情恶化。 我们团队此前调查了大脑内斑块的数量和可溶性Aβ-42的数量,是否对阿尔茨海默病的发展具有重大影响 。研究成果于今年10月发表在《阿尔茨海默病杂志》(Journal of Alzheimer’s Disease)。在调查过程中,我们分析了一组携带罕见遗传基因突变的志愿者的数据——这些突变使其面对很高的阿尔茨海默病风险。分析结果显示,相比于Aβ-42斑块的沉积量增加,可溶性Aβ-42数量的减少更危险。志愿者们接受了3年期的随访。在此期间,我们观察到那些脑脊液(大脑和脊髓周围的液体,也是前文提到的循环着可溶性Aβ的液体)里Aβ-42含量较高的人得到了更多大脑健康保护。这一事实也支持主流观点认为的“β淀粉样蛋白-42 在记忆和认知方面发挥重要作用”。此外,我们还研究了另一组携带基因突变并似乎正发展出阿尔茨海默病的人群。很多学者认为这些“患者”提供了能够证明“淀粉样蛋白斑块损害认知”一说的最有力证据。然而,即便是在这一组“患者”中,脑脊液内Aβ-42水平较高的人仍保有正常认知能力,哪怕他们脑中斑块数量非常高。值得一提的是,一些罕见的遗传性阿尔茨海默病病例并未被检测到斑块,却有着较少的可溶性Aβ-42。这似乎也在告诉我们,斑块并非导致痴呆的直接原因,低水平的淀粉样蛋白42才是。新药指引新方向 我们的发现将如何影响阿尔茨海默病的药物开发和临床试验? 在关于新药lecanemab的最新临床数据发布之前,所有阿尔茨海默病药物试验均告失败。 一些药物旨在整体性地降低β-淀粉样蛋白42的水平,其指导思想是,如果蛋白质总量少了,那么沉积的斑块量也会更少。不幸的是,这些药物常常恶化病人的状况。根据临床数据,lecanemab在18个月内将轻度认知障碍和早期阿尔茨海默病患者的认知能力下降速度减缓了27%;而先前的研究显示,lecanemab会提高脑脊液内Aβ-42的水平。 以上事实有力地支撑了我们的假设,即可溶性淀粉样蛋白的增加对大脑健康有益。 我们认为,未来的试验应重点关注可溶性Aβ-42,以增加患者的Aβ-42水平为目标而非减少它。而要实现此目标,不妨尝试寻找Aβ-42的“蛋白质类似物”,其结构功能类似于天然蛋白质,但更不容易聚集成斑块。 这种活性蛋白质替代法有望作为新工具,用于治疗阿尔茨海默病以及其他蛋白质聚集疾病,例如帕金森病和运动神经元疾病。来源: 世界科学
阿尔茨海默病新药有效!所有消减患者淀粉样蛋白斑块的努力可能都白费了? 最新数据显示,阿尔茨海默病新药lecanemab可显著改善患者的认知障碍:接受lecanemab治疗的早期阿尔茨海默病患者一年半后,认知功能的下降速度减缓27%。 这款新药产生疗效以及最新发表的学术论文,都指明一个方向:导致阿尔茨海默病的直接原因似乎不是我们过去以为的“β-淀粉样蛋白沉积”,而是“可溶性β-淀粉样蛋白水平降低”。新论文的作者团队于《对话》(The Conversation)杂志撰文介绍自己的颠覆性理论。 1906年,精神病学家兼神经解剖学家阿洛伊斯·阿尔茨海默(Alois Alzheimer)在德国蒂宾根的精神病学家聚会上报告了“大脑皮层的一种特殊而严重的病程”。 病例是一名50岁女性,表现出记忆力减退、错觉、幻觉、攻击性和精神错乱等症状,且病情不断恶化,直到5年后去世。在尸检过程中,阿尔茨海默教授注意到她大脑内存在明显斑块,也就是今天我们所谓的“β-淀粉样蛋白的团块”——主流理论中导致阿尔茨海默病的直接原因。然而,此理论有两大疑点, 一方面,它无法解释为什么许多人(甚至包括老年群体)在没有任何神经系统症状(例如记忆丧失)的情况下,大脑中也存在斑块。另一方面,旨在减少这些斑块的药物临床试验一直没能取得成功 ,直到最近,并不以减少斑块为目标的单克隆抗体药物lecanemab传来捷报。 斑块并非导致痴呆的直接原因,低水平的淀粉样蛋白才是。 β-淀粉样蛋白简称Aβ,是淀粉样前体蛋白的水解产物,可由多种细胞产生,循环于血液、脑脊液和脑间质液,其中一种亚型——Aβ-42,被主流理论认为与阿尔茨海默病密切相关。 当此类蛋白以不溶性的斑块形式积聚时,原本正常循环的、发挥着重要功能的可溶性Aβ便相应减少 。一些研究表明,可溶性β-淀粉样蛋白42水平的下降会导致患者病情恶化。 我们团队此前调查了大脑内斑块的数量和可溶性Aβ-42的数量,是否对阿尔茨海默病的发展具有重大影响 。研究成果于今年10月发表在《阿尔茨海默病杂志》(Journal of Alzheimer’s Disease)。在调查过程中,我们分析了一组携带罕见遗传基因突变的志愿者的数据——这些突变使其面对很高的阿尔茨海默病风险。分析结果显示,相比于Aβ-42斑块的沉积量增加,可溶性Aβ-42数量的减少更危险。志愿者们接受了3年期的随访。在此期间,我们观察到那些脑脊液(大脑和脊髓周围的液体,也是前文提到的循环着可溶性Aβ的液体)里Aβ-42含量较高的人得到了更多大脑健康保护。这一事实也支持主流观点认为的“β淀粉样蛋白-42 在记忆和认知方面发挥重要作用”。此外,我们还研究了另一组携带基因突变并似乎正发展出阿尔茨海默病的人群。很多学者认为这些“患者”提供了能够证明“淀粉样蛋白斑块损害认知”一说的最有力证据。然而,即便是在这一组“患者”中,脑脊液内Aβ-42水平较高的人仍保有正常认知能力,哪怕他们脑中斑块数量非常高。值得一提的是,一些罕见的遗传性阿尔茨海默病病例并未被检测到斑块,却有着较少的可溶性Aβ-42。这似乎也在告诉我们,斑块并非导致痴呆的直接原因,低水平的淀粉样蛋白42才是。新药指引新方向 我们的发现将如何影响阿尔茨海默病的药物开发和临床试验? 在关于新药lecanemab的最新临床数据发布之前,所有阿尔茨海默病药物试验均告失败。 一些药物旨在整体性地降低β-淀粉样蛋白42的水平,其指导思想是,如果蛋白质总量少了,那么沉积的斑块量也会更少。不幸的是,这些药物常常恶化病人的状况。根据临床数据,lecanemab在18个月内将轻度认知障碍和早期阿尔茨海默病患者的认知能力下降速度减缓了27%;而先前的研究显示,lecanemab会提高脑脊液内Aβ-42的水平。 以上事实有力地支撑了我们的假设,即可溶性淀粉样蛋白的增加对大脑健康有益。 我们认为,未来的试验应重点关注可溶性Aβ-42,以增加患者的Aβ-42水平为目标而非减少它。而要实现此目标,不妨尝试寻找Aβ-42的“蛋白质类似物”,其结构功能类似于天然蛋白质,但更不容易聚集成斑块。 这种活性蛋白质替代法有望作为新工具,用于治疗阿尔茨海默病以及其他蛋白质聚集疾病,例如帕金森病和运动神经元疾病。来源: 世界科学 -
 美国最新研究:“伟哥”在预防老年痴呆症上或有显著功效 西地那非(Sildenafil),俗称"伟哥",此前一直被用于治疗男性勃起功能障碍和肺动脉血压。而在一项最新的研究中,科学家们认为,伟哥在预防阿尔茨海默症(老年痴呆症)上或有显著功效。服"伟哥"与患老年痴呆风险降低69%存在显著关联当地时间12月6日,美国克利夫兰诊所基因组医学研究所博士、华裔科学家程飞雄领导的研究团队在《自然》杂志子刊《自然·衰老》上发表了一项最新研究结果——服用西地那非与患阿尔茨海默症的风险大幅降低69%存在显著相关。此前,在动物身上进行的研究已表明,"伟哥"可以预防和治疗阿尔茨海默症,但在人体试验中一直没有确凿的证据。在这项新的研究中,程飞雄博士的研究团队利用大型基因图谱网络,整合了遗传学和其他生物学数据,构建了能展现阿尔茨海默症生物学特征的13个疾病"内表型模块"。随后,团队在已获得美国食品和药物管理局(FDA)批准的1600多种现有药物中,开始寻找哪些可以有效治疗阿尔茨海默症。在观察了这1600多种药物与人体中超过35万种不同蛋白质的相互作用后,他们最终锁定了得分最高的西地那非。研究负责人程飞雄表示:"西地那非已被证明在临床前模型中显著改善认知和记忆,是最佳的候选药物。"随后,为验证西地那非与阿尔茨海默症的关联,研究团队对全美723万人的医疗保险数据进行了分析,以观察那些服用西地那非的人多年来的健康状况。研究表明,在服用西地那非的人群中,约99%的人在6年的时间里没有患上阿尔茨海默症。而那些没有服药的人,这个数字约为95%。为了进一步探索这一药物对阿尔茨海默症的潜在机制,研究人员在实验室中对来自阿尔茨海默症患者的神经细胞进行了药物测试,结果显示,西地那非促进了新的神经突起的生长,并以 tau 蛋白(阿尔茨海默症的特征之一)为靶点,减少了 tau 蛋白的积累。科学家们在已发表的论文中写道:"经过6年的随访,与匹配的非西地那非使用者相比,服用西地那非与患阿尔茨海默病的风险降低69%显著相关。""伟哥"可抑制有毒蛋白质积累同时,该研究团队也谨慎表示,虽然最新研究结果表明,服用"伟哥"的人患阿尔茨海默症的风险较低,但这并不能证明其中的因果关系。程飞雄博士称,为了确定西地那非的疗效,需要对男女两性患者开展随机临床试验,并进行安慰剂对照。尽管如此,牛津大学高级临床研究员伊万·科伊切夫博士称,"这项研究仍是一个令人兴奋的进展"。众所周知,针对阿尔茨海默症治疗药物的研发是全球药物研发失败率最高的领域。而二次利用现有药物的方法,可以将药物的研发周期缩短数年,并降低失败的风险。2020年7月,哈佛医学院的科学家曾在《美国国家科学院院刊》(PNAS)发表了一项研究称,PDE5抑制剂,即西地那非(伟哥)可以摧毁错误折叠蛋白,抑制体内有毒蛋白质的积累,这种有毒蛋白质的积累是导致阿尔茨海默症(老年痴呆)和帕金森症等疾病的主要原因。西地那非可以激活细胞蛋白质的"质量控制系统"蛋白酶体,提高其处理错误折叠蛋白质的能力。值得一提的是,辉瑞公司最初将"伟哥"作为治疗心血管疾病的5-磷酸二酯酶(PDE5)抑制剂而展开了临床研究。结果并没有达到预期目的,却"阴差阳错"发现了其对治疗男性勃起障碍效果更好。2020年,西地那非又获批了第二个适应症,用于治疗肺动脉高压。
美国最新研究:“伟哥”在预防老年痴呆症上或有显著功效 西地那非(Sildenafil),俗称"伟哥",此前一直被用于治疗男性勃起功能障碍和肺动脉血压。而在一项最新的研究中,科学家们认为,伟哥在预防阿尔茨海默症(老年痴呆症)上或有显著功效。服"伟哥"与患老年痴呆风险降低69%存在显著关联当地时间12月6日,美国克利夫兰诊所基因组医学研究所博士、华裔科学家程飞雄领导的研究团队在《自然》杂志子刊《自然·衰老》上发表了一项最新研究结果——服用西地那非与患阿尔茨海默症的风险大幅降低69%存在显著相关。此前,在动物身上进行的研究已表明,"伟哥"可以预防和治疗阿尔茨海默症,但在人体试验中一直没有确凿的证据。在这项新的研究中,程飞雄博士的研究团队利用大型基因图谱网络,整合了遗传学和其他生物学数据,构建了能展现阿尔茨海默症生物学特征的13个疾病"内表型模块"。随后,团队在已获得美国食品和药物管理局(FDA)批准的1600多种现有药物中,开始寻找哪些可以有效治疗阿尔茨海默症。在观察了这1600多种药物与人体中超过35万种不同蛋白质的相互作用后,他们最终锁定了得分最高的西地那非。研究负责人程飞雄表示:"西地那非已被证明在临床前模型中显著改善认知和记忆,是最佳的候选药物。"随后,为验证西地那非与阿尔茨海默症的关联,研究团队对全美723万人的医疗保险数据进行了分析,以观察那些服用西地那非的人多年来的健康状况。研究表明,在服用西地那非的人群中,约99%的人在6年的时间里没有患上阿尔茨海默症。而那些没有服药的人,这个数字约为95%。为了进一步探索这一药物对阿尔茨海默症的潜在机制,研究人员在实验室中对来自阿尔茨海默症患者的神经细胞进行了药物测试,结果显示,西地那非促进了新的神经突起的生长,并以 tau 蛋白(阿尔茨海默症的特征之一)为靶点,减少了 tau 蛋白的积累。科学家们在已发表的论文中写道:"经过6年的随访,与匹配的非西地那非使用者相比,服用西地那非与患阿尔茨海默病的风险降低69%显著相关。""伟哥"可抑制有毒蛋白质积累同时,该研究团队也谨慎表示,虽然最新研究结果表明,服用"伟哥"的人患阿尔茨海默症的风险较低,但这并不能证明其中的因果关系。程飞雄博士称,为了确定西地那非的疗效,需要对男女两性患者开展随机临床试验,并进行安慰剂对照。尽管如此,牛津大学高级临床研究员伊万·科伊切夫博士称,"这项研究仍是一个令人兴奋的进展"。众所周知,针对阿尔茨海默症治疗药物的研发是全球药物研发失败率最高的领域。而二次利用现有药物的方法,可以将药物的研发周期缩短数年,并降低失败的风险。2020年7月,哈佛医学院的科学家曾在《美国国家科学院院刊》(PNAS)发表了一项研究称,PDE5抑制剂,即西地那非(伟哥)可以摧毁错误折叠蛋白,抑制体内有毒蛋白质的积累,这种有毒蛋白质的积累是导致阿尔茨海默症(老年痴呆)和帕金森症等疾病的主要原因。西地那非可以激活细胞蛋白质的"质量控制系统"蛋白酶体,提高其处理错误折叠蛋白质的能力。值得一提的是,辉瑞公司最初将"伟哥"作为治疗心血管疾病的5-磷酸二酯酶(PDE5)抑制剂而展开了临床研究。结果并没有达到预期目的,却"阴差阳错"发现了其对治疗男性勃起障碍效果更好。2020年,西地那非又获批了第二个适应症,用于治疗肺动脉高压。 -
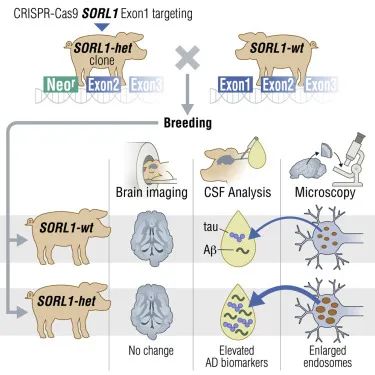
 基因缺陷猪为阿尔茨海默病的治疗提供了新的视角 研究人员克隆了一种基因突变的小型猪,这种基因突变最近被确定为导致阿尔茨海默病的直接原因。研究结果对制药行业来说尤其有意义。 几十年来,来自世界各地的研究人员一直在努力了解阿尔茨海默病。现在,丹麦奥胡斯大学(Aarhus University)生物医学系和临床医学系的合作培育出了一群小型猪,这可能会使阿尔茨海默病的研究和治疗向前迈进一大步。这些克隆猪出生时带有 SORL1 基因突变,这很有趣,因为在人类所有早发性阿尔茨海默病病例中,多达 2-3% 的病例中发现了这种突变。由于基因突变,猪在很小的时候就出现了阿尔茨海默病的症状。这给研究人员提供了一个跟踪疾病早期迹象的机会,因为猪显示出的生物标志物的变化与用于人类诊断的生物标志物相同。“通过跟踪猪随着时间的变化,我们可以更好地了解细胞中最早的变化。之后,这些变化会导致大脑发生不可逆转的变化,从而导致失智。但现在我们可以在猪失去记忆、行为改变等之前跟踪它们,这将使测试新药成为可能,这些新药可以在早期用于预防 SORL1 相关的阿尔茨海默病,”该研究的第一作者、生物医学系副教授 Olav Michael Andersen 说。该研究[1]近日发表在科学杂志《细胞报告医学》(Cell Reports Medicine)上。 研究于2022年9月12日发表在《Cell Reports Medicine》(最新影响因子:16.988)杂志上“猪在很多方面与人类相似,这就是为什么这增加了生产对抗阿尔茨海默病药物的可能性。重要的是要有一个可行的动物模型来弥合研究和药物开发之间的差距,” Olav Michael Andersen 解释说。奥胡斯大学临床医学系副教授Charlotte Brandt Sørensen(左)和生物医学系Olav Michael Andersen(右)从皮肤细胞克隆的猪 自 20 世纪 90 年代以来,研究人员已经知道有三种基因APP、PSEN1、PSEN2(如果它们发生突变)可以直接导致阿尔茨海默病。通过过去 20 年的密集研究,现在已经确定,第四个基因 SORL1 的突变也可以直接导致广泛存在的失智症。如果这种基因有缺陷,携带这种基因缺陷的人就会患上阿尔茨海默病。 “我们通过改变目前已知的与阿尔茨海默病直接相关的四个基因中的一个,在小型猪身上创建了一个动物模型。这些猪可以用于制药行业开发新药,与此同时,这可以为研究人员提供更好的可能性,以了解后来会患上阿尔茨海默病的人的大脑早期变化。” Olav Michael Andersen 说。此前,研究人员还通过克隆技术开发了阿尔茨海默病和其他疾病的猪模型。这是通过从猪的未受精卵细胞中去除遗传物质,然后将该细胞与来自另一头猪的皮肤细胞融合。在这项研究中,研究人使用了预先基于 CRISPR-Cas9 的基因编辑来破坏哥廷根小型猪(Göttingen minipig)皮肤细胞中的 SORL1 基因。哥廷根小型猪是世界上已知的最小的猪品种,成年后,它们的体重约为35公斤。哥廷根小型猪除了以其特别小的体型而闻名外,还以其温顺的天性和非常干净、特征鲜明的健康状况而闻名,其结果是一个重建胚胎,即克隆卵子,它发育成一个新的个体,具有与基因编辑皮肤细胞相同的遗传特征。这意味着克隆的小型猪出生时 SORL1 基因受损。负责开发转基因克隆猪的临床医学系副教授 Charlotte Brandt Sørensen 说:“这些猪类似于有 SORL1 基因缺陷的阿尔茨海默病患者,这与以前的阿尔茨海默病猪模型形成了对比,以前的猪模型是将一个或多个突变的人类基因插入,以加速疾病的发展。”由于这种突变是遗传的,研究人员现在可以培育出在三岁前就出现阿尔茨海默病最初症状的猪。能在疾病爆发前测试药物吗? Olav Michael Andersen 说“我们从人类遗传学中知道,当 SORL1 基因被破坏时,就会患上阿尔茨海默病。我们已经证明,如果破坏了猪的这个基因,动物的脑细胞就会发生我们期待的早期变化。这使得发现反映疾病最初、临床前阶段的生物标志物成为可能,”他说。 丹麦公司 Ellegaard Göttingen Minipigs 拥有该小型猪品种的专利,并正在饲养它们。“最好的办法是在这种猪模型的基础上开发新的药物,我们已经在准备方面取得了很大进展。携带 SORL1 突变的患者群体远远大于在其他三个已知基因中有错误的患者群体,” Olav Michael Andersen 说。事实:阿尔茨海默病和遗传学 遗传和环境因素都可能是阿尔茨海默病的病因。如果一个人有遗传易感性,这就会与其他风险因素,如生活方式(如吸烟和肥胖)和环境影响产生复杂的相互作用。在所有阿尔茨海默病患者中,只有大约 3% 的人是由于已知基因突变直接导致该疾病的。已知的导致阿尔茨海默病的致病基因有:APP、PSEN1、PSEN2——最近发现的是 SORL1。SORL1 基因于 1996 年在奥胡斯大学被发现。2021 年,Philip Scheltens 博士在《柳叶刀》(The Lancet)上的一篇文章[2]中确定它是阿尔茨海默病的病因。克隆小型猪的研究是 Olav Michael Andersen 副教授在 2022 年 9 月底获得阿尔茨海默病研究基金会基础研究奖的原因之一。参考文献Source:Aarhus UniversityPigs with gene defect provide new perspectives for the treatment of Alzheimer’sReferences:[1].Olav M. Andersen, Nikolaj Bøgh, Anne M. Landau, Gro G. Pløen, Anne Mette G. Jensen, Giulia Monti, Benedicte P. Ulhøi, Jens R. Nyengaard, Kirsten R. Jacobsen, Margarita M. Jørgensen, Ida E. Holm, Marianne L. Kristensen, Aage Kristian O. Alstrup, Esben S.S. Hansen, Charlotte E. Teunissen, Laura Breidenbach, Mathias Droescher, Ying Liu, Hanne S. Pedersen, Henrik Callesen, Yonglun Luo, Lars Bolund, David J. Brooks, Christoffer Laustsen, Scott A. Small, Lars F. Mikkelsen, Charlotte B. Sørensen. A genetically modified minipig model for Alzheimer’s disease with SORL1 haploinsufficiency. Cell Reports Medicine, 2022; 3 (9): 100740 DOI: 10.1016/j.xcrm.2022.100740[2]. Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, Cummings J, van der Flier WM. Alzheimer's disease. Lancet. 2021 Apr 24;397(10284):1577-1590. doi: 10.1016/S0140-6736(20)32205-4. Epub 2021 Mar 2. PMID: 33667416; PMCID: PMC8354300.免责声明天下无呆平台上的医疗信息仅作为信息资源提供与分享,不用于或依赖于任何诊断或治疗目的。此信息不应替代专业诊断或治疗。在做出任何医疗决定或有关特定医疗状况的指导之前,请咨询你的医生。阅读原文
基因缺陷猪为阿尔茨海默病的治疗提供了新的视角 研究人员克隆了一种基因突变的小型猪,这种基因突变最近被确定为导致阿尔茨海默病的直接原因。研究结果对制药行业来说尤其有意义。 几十年来,来自世界各地的研究人员一直在努力了解阿尔茨海默病。现在,丹麦奥胡斯大学(Aarhus University)生物医学系和临床医学系的合作培育出了一群小型猪,这可能会使阿尔茨海默病的研究和治疗向前迈进一大步。这些克隆猪出生时带有 SORL1 基因突变,这很有趣,因为在人类所有早发性阿尔茨海默病病例中,多达 2-3% 的病例中发现了这种突变。由于基因突变,猪在很小的时候就出现了阿尔茨海默病的症状。这给研究人员提供了一个跟踪疾病早期迹象的机会,因为猪显示出的生物标志物的变化与用于人类诊断的生物标志物相同。“通过跟踪猪随着时间的变化,我们可以更好地了解细胞中最早的变化。之后,这些变化会导致大脑发生不可逆转的变化,从而导致失智。但现在我们可以在猪失去记忆、行为改变等之前跟踪它们,这将使测试新药成为可能,这些新药可以在早期用于预防 SORL1 相关的阿尔茨海默病,”该研究的第一作者、生物医学系副教授 Olav Michael Andersen 说。该研究[1]近日发表在科学杂志《细胞报告医学》(Cell Reports Medicine)上。 研究于2022年9月12日发表在《Cell Reports Medicine》(最新影响因子:16.988)杂志上“猪在很多方面与人类相似,这就是为什么这增加了生产对抗阿尔茨海默病药物的可能性。重要的是要有一个可行的动物模型来弥合研究和药物开发之间的差距,” Olav Michael Andersen 解释说。奥胡斯大学临床医学系副教授Charlotte Brandt Sørensen(左)和生物医学系Olav Michael Andersen(右)从皮肤细胞克隆的猪 自 20 世纪 90 年代以来,研究人员已经知道有三种基因APP、PSEN1、PSEN2(如果它们发生突变)可以直接导致阿尔茨海默病。通过过去 20 年的密集研究,现在已经确定,第四个基因 SORL1 的突变也可以直接导致广泛存在的失智症。如果这种基因有缺陷,携带这种基因缺陷的人就会患上阿尔茨海默病。 “我们通过改变目前已知的与阿尔茨海默病直接相关的四个基因中的一个,在小型猪身上创建了一个动物模型。这些猪可以用于制药行业开发新药,与此同时,这可以为研究人员提供更好的可能性,以了解后来会患上阿尔茨海默病的人的大脑早期变化。” Olav Michael Andersen 说。此前,研究人员还通过克隆技术开发了阿尔茨海默病和其他疾病的猪模型。这是通过从猪的未受精卵细胞中去除遗传物质,然后将该细胞与来自另一头猪的皮肤细胞融合。在这项研究中,研究人使用了预先基于 CRISPR-Cas9 的基因编辑来破坏哥廷根小型猪(Göttingen minipig)皮肤细胞中的 SORL1 基因。哥廷根小型猪是世界上已知的最小的猪品种,成年后,它们的体重约为35公斤。哥廷根小型猪除了以其特别小的体型而闻名外,还以其温顺的天性和非常干净、特征鲜明的健康状况而闻名,其结果是一个重建胚胎,即克隆卵子,它发育成一个新的个体,具有与基因编辑皮肤细胞相同的遗传特征。这意味着克隆的小型猪出生时 SORL1 基因受损。负责开发转基因克隆猪的临床医学系副教授 Charlotte Brandt Sørensen 说:“这些猪类似于有 SORL1 基因缺陷的阿尔茨海默病患者,这与以前的阿尔茨海默病猪模型形成了对比,以前的猪模型是将一个或多个突变的人类基因插入,以加速疾病的发展。”由于这种突变是遗传的,研究人员现在可以培育出在三岁前就出现阿尔茨海默病最初症状的猪。能在疾病爆发前测试药物吗? Olav Michael Andersen 说“我们从人类遗传学中知道,当 SORL1 基因被破坏时,就会患上阿尔茨海默病。我们已经证明,如果破坏了猪的这个基因,动物的脑细胞就会发生我们期待的早期变化。这使得发现反映疾病最初、临床前阶段的生物标志物成为可能,”他说。 丹麦公司 Ellegaard Göttingen Minipigs 拥有该小型猪品种的专利,并正在饲养它们。“最好的办法是在这种猪模型的基础上开发新的药物,我们已经在准备方面取得了很大进展。携带 SORL1 突变的患者群体远远大于在其他三个已知基因中有错误的患者群体,” Olav Michael Andersen 说。事实:阿尔茨海默病和遗传学 遗传和环境因素都可能是阿尔茨海默病的病因。如果一个人有遗传易感性,这就会与其他风险因素,如生活方式(如吸烟和肥胖)和环境影响产生复杂的相互作用。在所有阿尔茨海默病患者中,只有大约 3% 的人是由于已知基因突变直接导致该疾病的。已知的导致阿尔茨海默病的致病基因有:APP、PSEN1、PSEN2——最近发现的是 SORL1。SORL1 基因于 1996 年在奥胡斯大学被发现。2021 年,Philip Scheltens 博士在《柳叶刀》(The Lancet)上的一篇文章[2]中确定它是阿尔茨海默病的病因。克隆小型猪的研究是 Olav Michael Andersen 副教授在 2022 年 9 月底获得阿尔茨海默病研究基金会基础研究奖的原因之一。参考文献Source:Aarhus UniversityPigs with gene defect provide new perspectives for the treatment of Alzheimer’sReferences:[1].Olav M. Andersen, Nikolaj Bøgh, Anne M. Landau, Gro G. Pløen, Anne Mette G. Jensen, Giulia Monti, Benedicte P. Ulhøi, Jens R. Nyengaard, Kirsten R. Jacobsen, Margarita M. Jørgensen, Ida E. Holm, Marianne L. Kristensen, Aage Kristian O. Alstrup, Esben S.S. Hansen, Charlotte E. Teunissen, Laura Breidenbach, Mathias Droescher, Ying Liu, Hanne S. Pedersen, Henrik Callesen, Yonglun Luo, Lars Bolund, David J. Brooks, Christoffer Laustsen, Scott A. Small, Lars F. Mikkelsen, Charlotte B. Sørensen. A genetically modified minipig model for Alzheimer’s disease with SORL1 haploinsufficiency. Cell Reports Medicine, 2022; 3 (9): 100740 DOI: 10.1016/j.xcrm.2022.100740[2]. Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, Cummings J, van der Flier WM. Alzheimer's disease. Lancet. 2021 Apr 24;397(10284):1577-1590. doi: 10.1016/S0140-6736(20)32205-4. Epub 2021 Mar 2. PMID: 33667416; PMCID: PMC8354300.免责声明天下无呆平台上的医疗信息仅作为信息资源提供与分享,不用于或依赖于任何诊断或治疗目的。此信息不应替代专业诊断或治疗。在做出任何医疗决定或有关特定医疗状况的指导之前,请咨询你的医生。阅读原文